Lo he leído y me ha parecido interesante, pero no tengo nada que aportar.
Esto es una respuesta hecha hilo. Me ha llevado un rato elaborarla y cuanta más gente aprenda con ella mejor. Aquí explico de forma relativamente simple qué es la entropía y por qué siempre tiende a crecer (2ª ley de la termodinámica):
"La entropía mide el número de microestados que conforman un posible macroestado." Esto es un poco confuso así de primeras si no estás metido en el ajo.
Lo explico mejor con un ejemplo, imagina que tienes como sistema dos hojas numeradas. Podemos decir que el sistema está en "orden" si las hojas están ordenadas, o sea hoja 1->hoja 2 y además ambas con la cara numerada mirando hacia ti. Vamos a contar el número de estados posibles del sistema, marcaré con un * las hojas cuya cara numerada no están mirando hacia ti(las que están al revés):
H1->H2
H1*->H2
H1->H2*
H1*->H2*
H2->H1
H2*->H1
H2->H1*
H2*->H1*
Como vemos hay 8 estados posibles, solo uno de ellos se corresponde con el estado de orden.
Ahora hay que diferenciar dos conceptos clave en termodinámica:
- Macroestados: es una abstracción que definimos nosotros, en este caso hay dos: orden y desorden.
- Microestados: son objetivos, los 8 que hemos contado.
Vemos que el macroestado de orden solamente tiene una única configuración posible(un único microestado), mientras que el desorden tiene 7.
Una vez vistos todos estos conceptos, veamos ahora cómo se define matemáticamente la entropía de un macroestado (ojo, no de un sistema sinó de un macroestado):
S=k*ln(W)
S es la entropía.
k es la constante de Boltzmann, solamente un número, ni caso.
ln es el operador logaritmo neperiano.
Aquí lo importante:
W es el número de microestados posibles que conforman dicho macroestado.
Podemos decir entonces que en nuestro sistema el orden se corresponde con una entropía de k*ln(1), como ln(1)=0 queda k*0 que es 0. La entropía del macroestado de orden es 0 en este caso.
En el caso del desorden nos queda una entropía de k*ln(7).
Ahora voy a decir algo que es clave: consideramos la entropía de un sistema como la entropía de su macroestado actual. De forma que, en nuestro caso, si el sistema está ordenado su entropía será 0 y si está desordenado será k*ln(7) que es mayor que 0, por eso hay quien dice que la entropía mide el grado de desorden.
Bien, si has entendido esto entenderás que si ahora cogemos las hojas al azar lo más probable es que no salgan en orden. En concreto la probabilidad de que salgan en orden es de 1/8, un 12,5%. De forma que el estado de mayor entropía será siempre el más probable.
Decir entonces que la entropía de un sistema aislado tiende a crecer no es más que decir que un sistema tiende hacia su configuración más probable, que en nuestro caso es lo mismo que decir que tiende hacia el desorden.
Si has entendido todo esto verás que la entropía no puramente una magnitud física sino que es más bien matemática, estadística, y que tiene todo el sentido del mundo que un sistema tienda hacia su configuración más probable (de mayor entropía). También verás que orden y desorden son conceptos humanos y no objetivos, podríamos haberlos definido al revés y habríamos concluido que nuestro sistema tiende hacia el orden. Lo que siempre se cumplirá, elijamos los macroestados que elijamos y los definamos como los definamos, es que el sistema tenderá hacia su macroestado más probable que será el de mayor entropía, ergo la entropía del sistema tenderá a crecer.
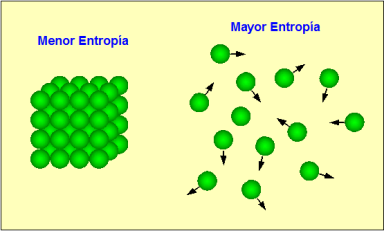
A mi para que comprendiese el concepto me lo explicaron de forma muy simple: imagina que tienes una pila de unos cuantos ladrillos, la pila de ladrillos representa el orden pero este es inestable, cualquier perturbación externa (un terremoto, la acción de una persona, un golpe de viento fuerte, etc) puede tirar los ladrillos al suelo, y estos pueden quedar de muchas maneras posibles en un estado de desorden. Bien, pues el aumento de la entropia es el aumento de la tendencia al desorden de todo el universo en conjunto.
Eso quiere decir que el aumento de la entropía condena al universo a tener un final, donde la entropía alcance su estado máximo y ya se quede el universo estático e inerte al no poder alcanzar estados de desorden mayores. Por eso el concepto de entropía va ligado al de irreversibilidad, hay situaciones que siguen un camino pero no pueden desandarlo, cuando tu quemas un trozo de madera en una fogata la oxidación del carbono libera energía en forma de calor y desprende el dióxido de carbono dejando las cenizas solidas que ya no pueden consumirse en el fuego, pero si coges dióxido de carbono y cenizas no puedes regenerar la madera añadiendole la energía liberada al conjunto. De la misma manera cuando una estrella consume su combustible y explota sus restos generan estrellas más pequeñas y sistemas planetarios con elementos más complejos, a cada ciclo estelar que se cumple queda menos energía y material consumible para mantener a futuras estrellas generando luz y calor, por eso la tendencia es que el universo se vaya quedando más oscuro y frio cada vez, y llegará un momento en el que no quede nada que genere luz y calor y permaneceremos en un universo oscuro y cada vez más estático.
Sin embargo, hay una cosa curiosa y es que la propia vida se resiste al aumento de la entropia, por eso nuestras células tratan de reparar la mayoría de ls daños que sufren como consecuencia de sus actividades metabólicas con los nutrientes y la energía que obtenemos del exterior. La vida podría decirse que reduce su propia entropía aumentando artificialmente la entropia de su entorno, sin embargo ese esfuerzo es en vano pues al final llega un momento en que los errores no reparados se acumulan y desencadenan la muerte, lo que hace que aumente nuestra entropía al dejar de comportarnos como un ser vivo tras morir.
Buena forma de explicarlo tambiénEl mensaje está oculto porque el usuario está en tu lista de ignorados.
¿A qué te refieres con modelos de la naturaleza?El mensaje está oculto porque el usuario está en tu lista de ignorados.
¿Por qué muere el ser humano?.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Bueno, desde que naciste piensa que te vas a tirar 80 o 90 años vivo, pero después te vas a tirar una eternidad muerto.
Contemplado desde la variable tiempo, el estado más probable del hombre es muerto.
Y por lo tanto es inevitable que tarde o temprano caigas en ese estado probable (osea que mueras).
¿Te parece buena explicación de la muerte?. ¿No?. Pues entonces entenderás por qué lo de arriba no es buena explicación de por qué la entropía crece.
De hecho no es sorprendente que una pelota ruede montaña abajo y luego no pueda volver a subirla (sin acción externa).
Lo sorprendente es qué fuerza hizo comenzar al universo en un estado de desequilibrio (qué dios colocó la pelota en la cima de la montaña), no por qué todo lo que contiene tiende al equilibrio (desorden) con el tiempo.
Última edición por Dark Gandalf; 16/04/2020 a las 11:28
Modelos fractales que impliquen un ordenEl mensaje está oculto porque el usuario está en tu lista de ignorados.
Si el principio de entropia fuera verdad estos patrones fractales de repetición con un orden perfecto llegaria el punto que presentarian una deformidad (caos en el orden) y no es asi.
He puesto literalmente la definición de entropía que dio el mismo Botzmann, es tan solo un contador de microestados. La entropía es una variable puramente probabilística, no física, no describe interacciones entre cuerpos. Es absurdo tratar la entropía como una teoría del todo que explique por sí sola la muerte, la vida, la creación del universo y mi microondas, es tan solo una propiedad de un sistema. Orden y desorden son macroestados que defines tú mismo, no son objetivos, de hecho en determinados sistemas el macroestado más probable y por tanto de mayor entropía es el que nosotros consideramos como de orden.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Puedes buscar más información si no te acaba de convencer mi explicación, pero el concepto es ese. De hecho hay una rama entera de la física basada en el concepto de entropía:
https://es.m.wikipedia.org/wiki/Física_estadística
No, orden y desorden son conceptos humanos. Un sistema puede perfectamente aumentar su orden conforma aumenta su entropía. Además, la entropía es probabilística. No siempre crece sin excepción, tiende a crecer.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Es porque orden y desorden solo son ideas que utilizamos para aproximarnos a la entropía.El mensaje está oculto porque el usuario está en tu lista de ignorados.
La entropía es la irreversibilidad de un trabajo producido por una energía en un sistema cerrado.
No que el resultado sea más desordenado o esté elegido entre más estados posibles.
Todo, absolutamente todo en esta vida, se puede aproximar mediante técnicas estadísticas. Pero eso no significa que la estadística sea la respuesta de nada.
La entropía se puede interpretar de muchas formas: grado de desorden, grado de irreversibilidad, pérdida de información, etc. Pueden ser todas correctas, pero la forma de calcularla es la que he expuesto, y dicha forma depende del número de microestados posibles para un macroestado. Cómo se interprete es cosa de cada uno, pero la definición es esa. Es una magnitud muy idealizada por quienes no la entienden.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Obviamente la estadística no es exacta, es una predicción aproximada en base a sucesos observados. Y es por eso que la física estadística no es exacta, es muy ideal y parte de una premisa fundamental: todos los microestados deben de ser equiprobables para que se pueda aplicar. Esta misma premisa la tienes en la página que te he pasado antes, no me estoy inventando nada.
Última edición por dinpolero; 16/04/2020 a las 14:55
No creas, la entropía considera que todos los microestados son equiprobables.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Mis neuronas han implosionado por lo que no tengo argumentos dialécticos con los cual rebatir. Lo que en idioma profano viene significado que no me he enterado de una pita mierda porque no me leo ese ladrillo ni con tus ojos
Menuda casualidad que después de hacer este hilo va este tío y explica exactamente lo mismo que yo me cago en todo:
@src @Dark Gandalf
Confiesa @dinpo. Tú eres Crespo.El mensaje está oculto porque el usuario está en tu lista de ignorados.
No he visto el vídeo, pero creo que te conviene recordar la explicación de entropía que se daba en el instituto.
El profesor cogía un vaso de agua fría, otro de agua caliente, y te decía: con la energía que hay en los vasos puedes realizar un trabajo:
Puedes calentar el frío, puedes enfriar el caliente. Puedes poner un molino y aprovechar el flujo de convección, etc.
Pero una vez mezclados, aunque la cantidad de energía calorífica es la misma, ya no puedes producir más trabajo con esa energía.
Esa irreversibilidad, ese por qué la energía pierde la capacidad de realizar trabajo, es la entropía.
Da igual que el estado final sea más desordenado. Al fin y al cabo, como decías antes, el "orden" no es una propiedad física de nada,
sino un constructo mental sobre ¿la posición? que tiene algo en el espacio con respecto a otro algo.
Que el estado final quede más desordenado, no es más que una consecuencia espuria de la entropía.
Y si interpretas la entropía por desorden, siempre habrá alguien que te venga a hablar de estructuras de complejidad creciente (ej: la vida).
Como la temperatura del agua en realidad es la energía cinética de las partículas que la componen, y son muchas, podrías estar tentado a contemplar el fenómeno "del orden" estadísticamente. A lo que yo siempre he preguntado ¿Y qué pasa, es que esa irreversibilidad no se da cuando una sola partícula choca contra otra?.
Hay un experimento por ahí (si quieres te lo busco) de unos señores que consiguieron violar el segundo principio de la termodinámica.
No es coña, lo hicieron. Consiguieron coger un cuerpo frío y usar su temperatura para calentar uno que estaba ya de por sí más caliente.
¿Donde está el truco?. Pues no hay truco. Lo que pasa es que no todas las interpretaciones que hacemos son correctas.
La temperatura de un cuerpo es un promedio.
Hasta en un cuerpo frío habrá partículas con alta energía cinética y viceversa: en uno caliente una cantidad pequeña de partículas "lentas".
Lo que hicieron es conseguir "seleccionar" esas partículas rápidas del cuerpo frío y transferir su energía a las partículas lentas del caliente.
Macroscópicamente ¿se ha violado la termodinámica? pues obvio que sí. Pero en realidad no: al universo le da igual que a lo que es un montón de partículas tú le llames balón solo porque andan juntas. Así que cuidado con las interpretaciones.
Yo creo que lo que dices está relacionado también con el número de configuraciones posibles. En ese caso creo que hablas de entalpía, otra magnitud termodinámica. Como un sistema tiende hacia el estado más probable que es, a su vez, el que tiene más microestados, volver al anterior es menos probable. En el ejemplo de las hojas es bastante probable, de 1/8, pero si pones miles de millones de átomos y haces el cálculo verás que no va a suceder nunca, al menos nosotros no lo vamos a ver. El número de átomos en un mol de agua (18g) es el número de Avogadro: 6,02*10^23, si te pones a hacer combinaciones posibles con ellos para el macroestado que quieras verás que te salen números absurdamente grandes. De forma que imagina que tiro un vaso de cristal al suelo y suponiendo que todos los microestados son igualmente probables(sé que es irreal): el macroestado de no rotura tiene una única configuración posible, el de rotura tiene inmensas. ¿Es esto reversible? Si después vuelvo a ordenar aleatoriamente los átomos de cristal ¿volveré a tener el vaso? La probabilidad no es 0, pero ni tú ni yo ni la humanidad entera ni seguramente el universo vivan tanto como para verlo cumplirse.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Cuidadín con la mecánica cuántica que puede dejar a unos cuanticos "hexpertos" sin palabras...El mensaje está oculto porque el usuario está en tu lista de ignorados.
https://universitam.com/academicos/n...nita-entropia/
Sí que es verdad que la cuántica está aún muy muy verde, y no saben muy bien cómo encajarla con la relatividad. Toca esperarEl mensaje está oculto porque el usuario está en tu lista de ignorados.
Como encaja la entropía en un concepto como el infinito?
Me explico, en el infinito hay una probabilidad del 100% de que todos los estados se den, es decir, no hay mayor ni menor entropía, al ser infinito todos los valores se igualan ya que hay las misma probabilidad para todos, no hay meta, simplemente sucede
Menciono a @Incógnito por si quiere opinar
¿En un sistema con infinitos elementos hay una probabilidad de que haya ausencia del propio sistema? ¿Existe un estado tal en el que todos los elementos se anulen?El mensaje está oculto porque el usuario está en tu lista de ignorados.
No estoy seguro de que la ausencia del infinito esté dentro del sistema del infinito. (No soy un experto en el tema)El mensaje está oculto porque el usuario está en tu lista de ignorados.
Si anulas algo que es, ese algo deja de ser.( no se si es una tonteria lo que acabo de decir, pero no se, me encaja) xd
Entonces hay un estado que al menos no se da, el cual es la ausencia de estados. Por tanto, un sistema con infinitos elementos no cumpliría con el 100% de estados posibles.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Yo k se no soy 100tifikoEl mensaje está oculto porque el usuario está en tu lista de ignorados.

Es decir ¿existe una probabilidad no nula de que el agua fluya hacia arriba, un yogur se caliente en el congelador del frigorífico, o la corriente eléctrica (electrones) de una pila fluya del positivo al negativo?.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Pero ya ni hablando macroscópicamente, no me refiero que todo el río suba del mar hacia la cumbre de la montaña, ¿existe la posibilidad de que una sola molécula de agua fluya por sí sola de menor energía potencial a mayor energía potencial?.
Por otro lado, un apunte sobre la probabilidad: la prob. es una medida de la frecuencia.
La probabilidad de que te toque la primitiva es de una entre 14 millones.
Pero eso no significa que debas echar apuestas 13.999.999 semanas y a la número 14 millones te toque.
Te puede tocar el primer día, y prob. se sigue cumpliendo. Incluso te puede tocar dos veces.
Eso de que hay que esperar la edad del universo para ver ocurrir un fenómeno porque su prob. es baja no es correcto.
Cada trozo de un vaso que se rompe no acaba donde acaba por casualidad, sino por un conjunto de causas: igual que un edificio que se derrumba acaba desparramado por el suelo en mil configuraciones posibles, pero entre ellas no está que cada ladrillo remonte y se vuelva a colocar en su sitio y el cemento vuelva a fraguar entre ellos.
La física estadística es válida si todos los microestados son equiprobables. No tiene en cuenta energías, fuerzas ni cinemática. Con esto respondo a la primera y tercera cuestión que planteas. En esos casos los microestados no son equiprobables. Lo cual no quiere decir que la entropía no sea útil.El mensaje está oculto porque el usuario está en tu lista de ignorados.
Respecto a la segunda, se puede modelar el fenómeno matemáticamente como una variable aleatoria binomial. La probabilidad de éxito aumenta con el número de experimentos. A más tiempo se entiende que se producen más experimentos, más casos. También puede verse como un proceso estocástico.